Los casos de miocarditis, diagnosticados clínicamente mediante pruebas de laboratorio y imágenes, se han descrito en el contexto de la vacunación contra el SARS-CoV-2 basada en ARNm. Falta una descripción basada en la autopsia de las características histológicas detalladas de la miocarditis inducida por la vacuna. Describimos los hallazgos de la autopsia y las características comunes de la miocarditis en personas no tratadas que recibieron la vacuna contra el SARS-CoV-2. Se realizaron autopsias estandarizadas en 25 personas que habían muerto inesperadamente y dentro de los 20 días posteriores a la vacunación contra el SARS-CoV-2. En cuatro pacientes que recibieron una vacuna contra el ARNm, identificamos una miocarditis aguda (epi-) sin detección de otra enfermedad significativa o constelación de salud que puede haber causado una muerte inesperada. La histología mostró una infiltración linfocítica T miocárdica intersticial parcial, predominantemente del subconjunto positivo CD4, asociada con daño leve de los miocitos. En general, los hallazgos de la autopsia indicaron la muerte debido a una insuficiencia cardíaca arritmogénica aguda. Por lo tanto, la miocarditis puede ser una complicación potencialmente letal después de la vacunación anti-SARS-CoV-2 basada en ARNm. Nuestros hallazgos pueden ayudar a diagnosticar adecuadamente los casos poco claros después de la vacunación y a establecer un diagnóstico oportuno in vivo, proporcionando así el marco para un monitoreo adecuado y un tratamiento temprano de los casos clínicos graves.
Resumen gráfico
Entre diciembre de 2020 y marzo de 2021, la Agencia Europea de Medicamentos aprobó varias vacunas sobre la base de ensayos aleatorios, ciegos y controlados: dos vacunas basadas en ARN mensajero: Comirnaty, BNT162b2 (Pfizer-BioNTech) y Spikevax, mRNA-1273 (Moderna), ambas codificando la proteína de pico del SARS-CoV COV2. S (Johnson & Johnson/Janssen), un vector de adenovirus recombinante tipo 26 que codifica la glicoproteína de espiga del SARS-CoV-2. Recientemente, las primeras vacunas de refuerzo bivalentes COVID-19 adaptadas dirigidas a las subvariantes Omicron (BA.1 y BA.4-5, respectivamente) se autorizaron en toda la Unión Europea (EMEA/H/C/005735: Comirnaty Original/Omicron BA.1, Comirnaty Original/Omicron BA.4-5; EMEA/H/
Como las vacunas pueden causar eventos adversos (AEFI), es crucial registrarlas sistemáticamente y evaluarlas por causa causalidad tanto a nivel de la población como individual, como lo propone la Organización Mundial de la Salud (OMS) [1]. Los análisis detallados deben tener como objetivo establecer o descartar un vínculo causal entre la vacunación y el evento en cuestión. La autopsia es una medida importante para identificar los efectos adversos graves y proporcionar datos mecanicistas importantes en este entorno. Puede permitir identificar a la población en riesgo y puede ayudar a desarrollar algoritmos para la prevención o el monitoreo, facilitando el diagnóstico precoz y el tratamiento exitoso.
Los casos de (epi)miocarditis se han documentado previamente después de la inmunización contra la viruela o la gripe en el sistema de notificación de eventos adversos de la vacuna [2, 3]. Recientemente, se han documentado casos inusuales de (epi)miocarditis después de la vacunación con vacunas anti-SARS-CoV-2 basadas en ARNm [4]. Estos fueron observados y diagnosticados clínicamente por resonancia magnética de laboratorio y cardíaca, predominantemente en hombres menores de 30 años [5,6,7,8]. Los datos de seguimiento a corto plazo disponibles sugieren la resolución de los síntomas [5,6,7]. Sin embargo, pocas personas necesitaban apoyo de cuidados intensivos o incluso murieron de insuficiencia cardíaca aguda. Todavía no se dispone de información sobre posibles resultados de salud a largo plazo. Verma et al. informaron dos casos de miocarditis después de la vacunación con ARNm, uno de ellos mortal, revelado por biopsia endomiocárdica y autopsia respectivamente [9]. La histología mostró un infiltrado inflamatorio compuesto predominantemente de células T y macrófagos, mezclados con eosinófilos, células B y células plasmáticas. Al informar observaciones similares basadas en diferentes técnicas de diagnóstico (por ejemplo, resonancia magnética cardíaca, biopsia endomiocárdica), la causalidad de un AEFI potencial se puede evaluar a nivel de población [1]. Sin embargo, en la mayoría de estos estudios no se informaron pruebas exhaustivas de agentes infecciosos, cruciales para la evaluación de un AEFI a nivel individual. Como consecuencia, todavía falta una descripción sistemática con fenotipo histopatológico, así como un análisis molecular de la (epi-)miocarditis después de la vacunación contra el SARS-CoV-2.
Aquí, describimos los hallazgos de la autopsia cardíaca en cinco personas que han muerto inesperadamente dentro de los siete días posteriores a la vacunación contra el SARS-CoV-2, con la inflamación miocárdica inducida por la vacuna que representa la causa probable o posible de muerte. Nuestros hallazgos establecen el fenotipo histológico de la miocarditis letal asociada a la vacunación.
Materiales y métodos
Los datos sobre autopsias de personas que recibieron la vacuna contra el SARS-CoV-2 (hasta 20 días antes de su muerte) se obtuvieron del registro de autopsia y biomateriales de COVID de Baden-Württemberg. Este registro estatal federal contiene datos de autopsia, clínicos y patológicos, así como muestras de tejido de pacientes que han muerto en el contexto de una infección por SARS-CoV-2 o de personas que han muerto brevemente después de una vacunación contra el SARS-CoV-2 (n = 54). Todas las autopsias se realizaron en uno de los cinco hospitales de la Universidad (Heidelberg, Tübingen, Friburgo, Ulm, Mannheim) de Baden-Württemberg. La red coopera con la fiscalía y la patología forense, así como con otras redes nacionales como el Centro Alemán de Investigación de Infecciones (DZIF), el Centro Alemán de Investigación Pulmonar (DZL) y la red nacional de investigación académica NUM (Red de Medicina Universitaria; DEFEAT PANDEMIcs); los resultados se informan constantemente al Instituto Paul Ehrlich (PEI), el Instituto Federal Alemán En este estudio, se incluyeron todas y únicas autopsias realizadas en el Hospital Universitario de Heidelberg (n = 35) para garantizar que todos los documentos y hallazgos médicos estuvieran disponibles y que las autopsias se realizaran de acuerdo con el procedimiento estandarizado descrito anteriormente [10]. Los corazones se examinaron macroscópicamente midiendo el peso y el grosor de las paredes izquierda, derecha e interventricular. Las arterias coronarias se diseccionaron desde su ramificación aórtica hasta la periferia para permitir la evaluación de la arteriosclerosis y la exclusión de los trombos. Posteriormente, se examinaron los tractos de entrada y salida, los ventrículos se cortaron en un eje corto (plano transversal) a intervalos de 1 cm desde las válvulas hasta el ápice y se examinaron las superficies cortadas en en en caso de lesiones focales (o demarcaciones geográficas), no se realizó una disección enfocada y una evaluación histológica detallada del sistema de
Para la evaluación histológica, todas las muestras de tejido se fijaron en formalina con búfer de búfer neutro al 4 %. Se tomaron al menos dos bloques de grosor total de la pared ventricular izquierda y derecha, el tabique interventricular y los músculos papilares para la evaluación histológica de las patologías cardíacas. A partir de bloques de tejido fijos en formalina, incrustados en parafina (FFPE), al menos dos secciones con un grosor de 4 μm se tiñieron con hematoxilina y eosina, reacción periódica de Schiff (PAS) y naranja ácida fuctina G (AFOG), respectivamente. Las manchas inmunohistoquímicas se realizaron de acuerdo con los protocolos estándar. En resumen, la inmunohistoquímica se realizó en un inmunoestainer automatizado (Ventana BenchMark Ultra, Ventana Medical Systems, Tucson, EE. UU.). Las secciones se cortaron, desparafinadas, se rehidrataron y se trataron previamente con un tampón de recuperación de antígenos (Tris/Borat/EDTA, pH 8,4). Después del bloqueo de la peroxidasa endógena, las diapositivas se incubaron con anticuerpos monoclonales dirigidos contra CD3 (clo 2GV6, Roche, Rotkreuz, Suiza), CD4 (clon SP35, Roche), CD8 (clo SP57, Roche), CD20 (clo L26, Roche), GATA 3 (clo L50-823, Roche, Rotkreuz, incubación con OptiView Universal Linker y OptiView HRP Multimer. La visualización se logró utilizando DAB como cromogénico. Antes del montaje, las diapositivas se manchaban con hematoxilina. Los hallazgos histológicos e inmunohistológicos se analizaron en una sinopsis con los datos disponibles de los registros médicos de los pacientes. Se recuperaron tres cohortes de edad y sexo de nuestros archivos de autopsia (que cubren los años 2005/2006, 2010/2011 y 2015/2016) y se evaluaron las muestras miocárdicas para la presencia y el fenotipo de infiltrados inflamatorios.
Basado en los criterios de Dallas y las especificaciones de acuerdo con Caforio et al. La miocarditis fue definida por un infiltrado inflamatorio con ≥ 14 leucocitos/mm2 incluyendo hasta 4 monocitos/mm2 con la presencia de linfocitos T CD3 positivos ≥ 7 células/mm2y signos de degeneración de miocitos La infiltración miocárdica y epicárdica se evaluó semicuantitativamente mediante puntuación visual utilizando un sistema de cuatro niveles (0–3): puntuación 0 (sin focos de inflamación), puntuación 1 (focos focos, aislados con hasta 20 leucocitos/mm2), puntuación 2 (focal, > 20 leucocitos/mm2) y puntuación 3 (infiltración difusa). En cuanto a los posibles agentes infecciosos causantes, las muestras FFPE de todos los casos y las muestras miocárdicas frescas congeladas de los casos 1, 3, 4 y 5 se probaron para genomas virales y bacterianos por un panel de diagnóstico con PCR (transcripción inversa) (entevirus, parvovirus B19, herpesvirus humano 6, virus Epstein Para cada muestra, se extrajeron 350 ng de ácido nucleico total y se sometieron a PCR anidada (RT) utilizando técnicas internas como se describe por Mahfoud et al. [13]. La RT-PCR de gliceroldehído-3-fosfato deshidrogenasa (GAPDH) sirvió como control interno tanto para la extracción de ácido nucleico como para la amplificación de PCR.
La probabilidad de (epi)miocarditis inducida por la vacuna se clasificó de acuerdo con los criterios detallados en la Tabla 1.Tabla 1 Evaluación de la probabilidad de la (epi)miocarditis inducida por la vacuna
Resultados
Entre los 35 casos de la Universidad de Heidelberg, las autopsias revelaron otras causas de muerte (debido a enfermedades preexistentes) en 10 pacientes (Tabla Suplementaria 1). Por lo tanto, estos fueron excluidos de un análisis posterior. Los hallazgos de la autopsia cardíaca consistentes con (epi-)miocarditis se encontraron en cinco casos de los 25 cuerpos restantes encontrados inesperadamente muertos en casa dentro de los 20 días posteriores a la vacunación contra el SARS-CoV-2. Las principales características de los cinco casos se presentan en la Tabla 2, mientras que los hallazgos adicionales de la autopsia se muestran en la Tabla Suplementaria 2. Tres de las personas fallecidas eran mujeres, dos hombres. La edad media a la muerte fue de 58 años (rango de 46 a 75 años). Cuatro personas murieron después de la primera vacuna, el caso restante después de la segunda dosis. Todas las personas murieron dentro de la primera semana siguiente a la vacunación (media 2,5 días, media de 2 días). Los hallazgos clínicos, los análisis de sangre, los ECG o los datos de imagen no estaban disponibles, ya que las personas fallecidas no buscaron atención médica antes de la muerte. La persona 1 fue encontrada muerta 12 horas después de la vacunación. Un testigo describió un aliento traqueteo poco antes de descubrir un fallo circulatorio. La persona 2 se quejó de náuseas y fue encontrada muerta poco después. La reanimación se inició de inmediato, pero sin éxito, respectivamente. Las otras personas fueron encontradas muertas en casa sin información disponible sobre los síntomas terminales. Según la información disponible proporcionada en el momento de las autopsias, ninguna de las personas fallecidas tenía infección por SARS-CoV-2 antes de la vacunación y los hisopos nasofaríngeos fueron negativos en todos los casos.
Tabla 2 Características del caso
El examen histológico mostró infiltración inflamatoria del miocardio. El infiltrado era focal e intersticial en todos los casos. Se detectó predominantemente en secciones tomadas de la pared ventricular derecha y del tabique interventricular. La caracterización histológica e inmunohistoquímica reveló que el infiltrado inflamatorio estaba compuesto predominantemente por linfocitos. El número de células T CD3 positivas superó con mucho en número a las pocas células B CD20 positivas detectadas. Además, la mayoría de las células T pertenecían al subconjunto CD4 positivo, mientras que solo se veían células T CD8 positivas dispersas (Fig. 1, 2, Fig. Suplementario 1/2). Las células T fueron negativas para Tbet como marcador para las células Th1, GATA3 como marcador para las células Th2, D2-40, como marcador para las células Th17 (Suplemento Fig. 2). Además, las células T reguladoras positivas FOXP3 y las células dendríticas foliculares positivas a CD21 no se detectaron dentro de los infiltrados cardíacos, mientras que los casos de control, incluidos los casos de sarcoidosis, fueron positivos (Fig. complementaria 2/3). La inmunohistoquímica de CD68 mostró pocos histiocitos intercalados (Fig. 2, Fig. Suplementario 1). La lesión de miocitos microfocales fue demostrable en tres casos (pacientes 1, 2 y 3). No se encontraron granulomas. Todos los casos carecían de enfermedad coronaria significativa, manifestaciones agudas o crónicas de cardiopatía isquémica, manifestaciones de miocardiopatía u otros signos de una enfermedad cardíaca preexistente y clínicamente relevante.
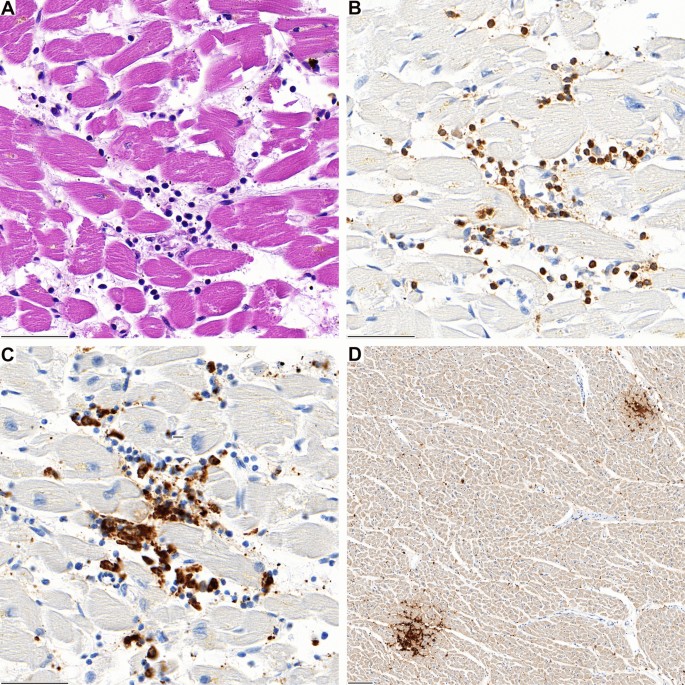

En la mayoría de los casos, se encontró concomitantemente una infiltración inflamatoria del epícardio y del tejido adiposo subepicardial (casos 2, 3, 4 y 5; Fig. Suplementaria 4) y reveló un inmunofenotipo idéntico. (celular dominante; CD4 > > CD8). En el caso 2, también se registró una infiltración linfocítica prominente CD4 positiva en el sitio de la jab del músculo deltoidal (Fig.3). El análisis de posibles agentes infecciosos que causan una miocarditis reveló un bajo número de copias virales del virus del herpes humano 6 (HHV6) en un caso (caso 5). Los resultados de los otros cuatro casos fueron negativos para todos los agentes infecciosos probados, pero demostraron una amplificación regular del control GAPDH, lo que sugiere una calidad adecuada del ácido nucleico para el análisis.

En tres casos, los hallazgos generales de la autopsia, en particular la presencia de (epi-)miocarditis en combinación con la ausencia de otras causas plausibles de muerte (especialmente embolia pulmonar, infarto de miocardio, infarto cerebral grave o sangrado, otras enfermedades cardíacas), junto con la estrecha asociación temporal con el evento de vacunación, llevaron a la conclusión de que la vacunación fue la Para el caso 5, la miocarditis también se consideró la causa de muerte, pero la detección de HHV6, incluso en números bajos de copias virales, proporcionó una explicación alternativa para la presencia de miocarditis. Con respecto a la cuestión de un AEFI fatal, el caso 5 se clasificó como «posible». Para el caso 3, no se encontró otra causa para la infiltración inflamatoria, pero el infiltrado fue discreto y se observó principalmente en la grasa pericárdica. Por lo tanto, el caso 3 también se clasificó como posible AEFI. No encontramos una asociación obvia entre los infiltrados y las células endoteliales (CD31, D2-40), las células mesoteliales (calretinina) o las células neuronales (S100). Durante los últimos 20 años de servicio de autopsia en el Hospital Universitario de Heidelberg, no observamos una infiltración inflamatoria miocárdica comparable. Esto fue validado por una reevaluación histológica de cohortes igualadas por edad y sexo de tres períodos independientes, que no revelaron un solo caso que mostrara una patología cardíaca comparable.
Discusión
Se han publicado varios casos de miocarditis después de la vacunación contra el SARS-CoV-2 [4,5,6, 9, 14]. Los síntomas suelen ocurrir dentro de los primeros tres días siguientes a la segunda dosis de las vacunas de ARNm COVID-19 (Comirnaty y Spikevax, respectivamente) y los pacientes jóvenes que presentan dolor en el pecho se ven predominantemente afectados. Los hallazgos clínicos como los niveles séricos elevados de troponina, elevaciones anormales de ST en el ECG y el movimiento alterado del ventrículo en el ecocardiograma o la mejora tardía en la resonancia magnética cardíaca sugirieron el desarrollo de una miocarditis. La mayoría de los casos notificados mostraron cursos clínicamente leves con resolución de los síntomas sin tratamiento. Sin embargo, en casos raros, las personas necesitaban apoyo de cuidados intensivos o incluso murieron de insuficiencia cardíaca aguda, como se describe en un informe temprano de Verma et al. [9]. Estos estudios, con sus diferentes modalidades de diagnóstico aplicadas, ya señalaron un vínculo entre la vacunación y la miocarditis, aunque muchos de estos estudios carecen de pruebas exhaustivas para agentes infecciosos. En particular, los estudios de cohortes de autopsia, así como la información sobre posibles resultados a largo plazo, aún no están disponibles [15,16,17].
A través de nuestro enfoque basado en la autopsia, identificamos cinco casos de miocarditis linfocítica (epi-) en personas, que fueron encontradas inesperadamente muertas en casa dentro de la primera semana después de la inmunización anti-SARS-CoV-2 mediada por el ARNm. De acuerdo con los criterios de Dallas, se clasificaron cuatro muestras como miocarditis definitiva. En el caso restante, se encontró una infiltración inflamatoria comparable del epicardio, la grasa subepicardia y el miocardio, pero la infiltración miocárdica no superó el umbral de los criterios de Dallas. Todos los casos mostraron un fenotipo consistente: (A) infiltración miocárdica linfocítica intersticial focal, en tres casos acompañada de destrucción de miocitos microfocales demostrable. (B) infiltrado dominante de células T con células T positivas para CD4 superando en número a las células T CD8 positivas en número; (C) frecuentemente asociado con infiltración de células T del epicardio y tejido adiposo subepcárdico que revela un fenotipo inmune similar (CD4 > > CD8).
Como es bien conocido por el infarto de miocardio, hay que considerar que la manifestación microscópicamente visible del daño miocárdico en tales condiciones agudas puede estar por detrás de la función; esto puede estar relacionado con aspectos de la composición de infiltrados, como el contenido relativamente bajo de macrófagos o el daño histológicamente focal de los micitos. Por lo tanto, los efectos funcionales pueden ser mucho más fuertes de lo esperado teniendo en cuenta el cuadro histológico. Esto se refleja en el hecho de que la miocarditis es una de las principales causas de muerte repentina e inesperada en bebés, adolescentes y adultos jóvenes con frecuencias que oscilan entre el 1 y el 14 % entre los jóvenes [18,19,20,21]. Como se describe en la sección de materiales y métodos, la evaluación de la probabilidad de un AEFI refleja la asociación temporal y los hallazgos de la autopsia (con exclusión de otras razones de muerte súbita), y las pruebas moleculares negativas para posibles causas infecciosas. Por lo tanto, el caso 5 con ADN HHV6 detectado con números de copia bajos se clasificó como sea posible. En general, un vínculo causal entre la miocarditis y la vacunación contra el SARS-CoV-2 está respaldado por varias consideraciones: (A) una estrecha relación temporal con la vacunación; todos los casos se encontraron muertos dentro de una semana después de la vacunación, (B) ausencia de cualquier otra enfermedad cardíaca preexistente significativa, especialmente cardiopatía isquémica o miocardiopatía, (C) pruebas Este último criterio está respaldado por la demostración de un infiltrado de células T fenotípicamente idéntico en el sitio de inyección deltoidal en uno de los casos. Hay que enfatizar que no se encontró una infiltración (epi)miocárdica comparable en ninguna de las otras 20 autopsias realizadas en cuerpos encontrados muertos dentro de los 20 días posteriores a una vacunación contra el SARS-CoV-2, ni en las cohortes igualadas por edad y sexo de tres períodos independientes de nuestros archivos de autopsia.
Sobre la base de los hallazgos de la autopsia y todos los datos disponibles, no se identificó ninguna otra causa de muerte, excepto (epi)miocarditis, en ninguno de los casos presentados aquí. Por lo tanto, la miocarditis debe considerarse la causa probable de muerte. Desde un punto de vista funcional, el daño miocárdico en nuestros casos no es suficiente para postular la insuficiencia contráctil como causa terminal de muerte; por lo tanto, la insuficiencia arrítmica, ya sea por paro cardíaco o por fibrilación ventricular, debe asumirse como el mecanismo que conduce a la muerte de los pacientes. El paro cardíaco agudo relacionado con la miocarditis debido a la asystosis o la fibrilación ventricular es un pathomecanismo bien establecido en otras causas de miocarditis aguda también [22, 23].
Con respecto a la posible patogénesis subyacente de la (epi-)miocarditis, nuestros hallazgos permiten algunas consideraciones. Además de la neumonía, la miocarditis es otra manifestación notificada durante la infección por SARS-CoV-2 [24]. Se está debatiendo si la miocarditis en COVID-19 es causada principalmente por la infección viral o si ocurre secundaria como consecuencia de la respuesta inmune del huésped, en particular por la citotoxicidad mediada por linfocitos T o como consecuencia de la tormenta de citoquinas observada durante COVID-19 [25]. Por lo tanto, parece posible que un micomerismo molecular entre la proteína de pico del SARS-CoV-2 y los autoantígenos pueda desencadenar una respuesta inmune antimiocítica en individuos predispuestos. Múltiples estudios de vacunas de ARNm mostraron anticuerpos sólidos específicos del dominio del receptor, las células T y las respuestas de las citoquinas [26]. Las células T, especialmente las células T CD4 +, son los principales impulsores de la autoinmunidad específica del corazón en la miocarditis [27]. Una activación del sistema inmunitario inducida por la vacuna en personas con tolerancia periférica debido a las células T reguladoras podría promover la expansión de las células T del efector CD4 + y la miocarditis. Teniendo en cuenta que la (epi-)miocarditis aún no se ha descrito después de la inmunización anti-SARS-CoV-2 basada en vectores, también podría ser posible que la respuesta inmunitaria pueda dirigirse contra el ARNm u otros componentes de la fórmula de la vacuna. Sin embargo, se informa que la vacuna contra la viruela, basada en un virus de la vaccinia, causa (epi)miocarditis en casos raros [2, 3]. Cabe destacar que recientemente se ha informado de que la inyección intravenosa de la vacuna de ARNm COVID-19 es capaz de inducir una miocarditis aguda (epi-) en un modelo preclínico [28]. Curiosamente, registramos focos inflamatorios predominantemente en el corazón derecho, lo que puede sugerir un efecto gradual de dilución derivado del torrente sanguíneo y, en base a este hallazgo, al menos es tentador especular que la inyección inadvertida de la vacuna intravascular puede ser contributiva.
Nuestro estudio está limitado por el tamaño relativamente pequeño de la cohorte y hereda el sesgo de un análisis de punto final. La naturaleza de nuestro estudio de autopsia requiere que los datos sean descriptivos en calidad y no permita ninguna conclusión epidemiológica en términos de incidencia o estimación de riesgos. La incidencia reportada de (epi)miocarditis después de la vacunación es baja y se afirma que los riesgos de hospitalización y muerte asociados con COVID-19 son mayores que el riesgo registrado asociado con la vacunación contra la COVID-19 [29]. Es importante destacar que los agentes infecciosos también pueden causar miocarditis linfocítica con un inmunofenotipo similar, por lo que se requieren análisis moleculares meticulosos en todos los casos de miocarditis potencialmente asociada a la vacunación.
Con respecto a un posible mecanismo autoinmunológico que explica el daño miocárdico, el examen histológico de los ganglios linfáticos podría ser de interés, ya que Röltgen et al. describieron la arquitectura alterada del centro germinal después de la vacunación contra la COVID-19 [30]. Este aspecto no pudo abordarse en nuestro análisis, ya que el muestreo sistemático de ganglios linfáticos no formaba parte de nuestro protocolo de autopsia estandarizado.
Por último, no podemos proporcionar una prueba funcional definitiva o un vínculo causal directo entre la vacunación y la miocarditis. Se necesitan más estudios y un registro ampliado para identificar a las personas en riesgo de esta AEFI potencialmente mortal y pueden ser ayudados por análisis clínicos, serológicos y moleculares detallados que estaban fuera del alcance de este estudio. Teniendo en cuenta que este evento adverso mortal puede afectar a personas sanas, dichos programas de registro y vigilancia pueden mejorar el diagnóstico precoz, la supervisión cercana y el tratamiento.
Fuente: https://link.springer.com/article/10.1007/s00392-022-02129-5